小分子化合物(SMCs)平均分子質量小於5000 Da��
,在免疫化學中被歸類為半抗原��
。SMCs指的是內源性化合物(如激素)��
,外源性藥物(如藥物)��
,或自然和人工環境汙染物(如真菌毒素或農藥)��
。從環境和食品安全監測到臨床診斷��
,監測SMCs需要使用快速和靈敏的監測技術��
,以確保最大療效和相關性��
。越來越多研究涉及SMC監測方法�
,如HPLC(高效液相色譜)��
,GC(氣相色譜)��
,LC-MS/MS(液相色譜-串聯質譜)��
,SPR(表麵等離子體共振)和其他相關技術��
。雖然這些方法具有很高的靈敏度和特異性��
,但由於樣品前處理耗時且複雜��,設備昂貴以及需要受過專業培訓的技術人員��
,不適用於現場快速檢測��。基於抗原-抗體特異性結合的免疫化學分析(ICAs)具有價格低廉��
、操作簡單��
、通量高��
、檢測快速等優點��
。因此��
,ICAs不僅在前沿研究中非常突出��
,還能應用於相關現場檢測��
。
ICAs有兩種反應模式�
:競爭和非競爭(圖1)��
。在某些情況下��
,SMCs可能受到大小或結構的限製��
,隻具有一個合適的免疫結合位點��
,為單表位抗原��
。競爭ICA反應模式最適合這些靶標SMCs�
。靶標分析物將與標記的半抗原競爭結合固定濃度的抗體��
。當該反應達到平衡時��
,去除遊離半抗原��
,並監測特異性結合產生的信號��
,其與靶標分析物濃度成反比�
。競爭免疫分析法的靈敏度受到抗原抗體親和力的限製��
,當親和常數(Ka)大於10-12mol/L時��
,靈敏度可達到10-12mol/L水平��
。但抗體的親和常數(Ka)通常小於1010 mol/L��
,因此�
,競爭性ICA往往表現出相對較低的靈敏度��,使得在靶標濃度非常低的情況下很難區分陰性和陽性樣品�
,難以滿足汙染物檢測的基本應用需求��
。這種模式在靶標低濃度情況下也會產生較大的誤差��
,導致準確度��
、重複性��
、靈敏度和線性範圍較差��
。
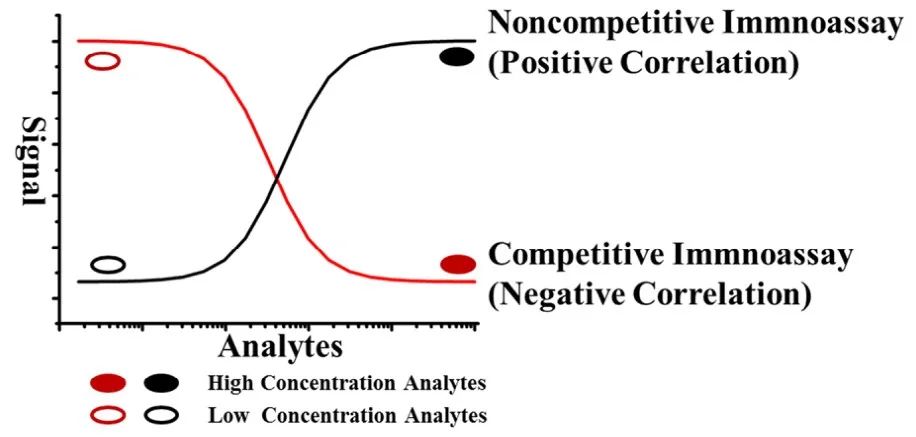
圖1 競爭性與非競爭性免疫分析的差異
另一方麵��
,非競爭性ICA通常應用於具有多表位的大分子抗原的檢測��
,常用的非競爭性免疫分析法是夾心ELISA��
。在夾心ELISA過程中��
,使用兩種不同的抗體在靶標分子周圍形成夾心��
,其中一種抗體捕獲靶標(捕獲抗體)��
,另一種抗體被標記(檢測抗體)��
,能夠產生與靶標物濃度成正比的信號�
。在非競爭性ICA中��
,抗原必須是具有多個表位的多價抗原��
,以便能夠同時與捕獲抗體和檢測抗體結合��
。
用於監測SMCs的有效非競爭性ICAs的設計依賴於對關鍵試劑的適當選擇��
,如抗體��
、吸附性載體材料��
、特異性半抗原標記物��
。多克隆抗體和單克隆抗體雖然供應豐富且種類繁多��
,但也表現出了一些缺點��
,有時靈敏度��
、親和力��
、穩定性或種屬特異的識別特征不能滿足應用需求��
。為了解決這些問題�
,通過新的生物識別材料(如受體蛋白��
、重組抗體和適配體)拓寬了該平台的能力��
。此外��
,ICA平台已經開始廣泛應用新的標記��
,如鑭係螯合物��
、量子點(QDs)和DNA測序��
,使ICA平台用於SMCs非競爭性檢測具有可行性��
。
由於這些新技術具有更寬的檢測範圍��
、更高的靈敏度及易於自動化的顯著優勢��
,因此研究人員專注於開發SMCs的非競爭性分析��
。迄今為止��
,基於化學修飾半抗原和專用分離設備��
、新型抗體以及其他相關技術的非競爭性反應模式的相關報道較多��
。本文綜述了六種用於檢測SMCs的非競爭性反應設計��
:基於生物素-親和素係統的雙表位夾心非競爭性免疫分析(BA-NIA)��
、基於固相固定化表位的非競爭性免疫分析(SPIE–NIA)��
、基於抗獨特型抗體的非競爭性免疫分析(AIA–NIA)��
、基於抗免疫複合物抗體的非競爭性免疫分析(AICA-NIA)��
、開放式夾心非競爭性免疫分析(OS-NIA)和基於標記分析物抗體置換的非競爭性免疫分析(DLA-NIA)��
。綜述了六種設計方法的基本原理和應用現狀��
。
1.基於生物素-親和素係統的雙表位夾心非競爭性免疫分析(BA-NIA)
BA-NIA技術由Ishikawa首先提出並應用於小分子多肽��
。由於SMCs的表位單一��
,傳統的雙位點ICAs無法檢測��
。這種非競爭性設計依賴於使用強親和係統��
,即生物素-親和素複合物��
,與分析物共價連接來獲得兩個位點的免疫檢測��
。檢測原理是用適當的物質標記待測半抗原��
,修飾的半抗原可以同時結合標記識別元件和抗體��
,從而實現雙位點非競爭性分析��。具體來說��
,靶標分析物被生物素化��
,能夠配對結合形成複合物��
,例如固相吸附的親和素類似物和可檢測的標記抗體��
。這樣��
,SMCs可以通過夾心非競爭性免疫分析法進行檢測��
。具體反應步驟如下(圖2):1)將靶標分析物與生物素結合��
,從而產生一個體積更大的複合物��
,該複合物也具有第二個表位��
。2)生物素化分析物經免疫親和柱純化後與標記抗體混合��
。3)將混合物轉入預包被親和素的酶標板��
,進行夾心非競爭性反應��
。4)最後��
,記錄信號強度��
,觀察到信號強度與靶標分析物濃度呈正相關��
。

圖2 生物素親和素體係雙表位夾心非競爭性免疫分析方案
Ishikawa首次用血管緊張素I證明了這一原理的可行性�
,血管緊張素I是一種由10個氨基酸組成的單鏈肽��
,也可歸為小分子半抗原��
。將血管緊張素I生物素化�
,然後用抗血管緊張素I Fab'-HRP偶聯物和鏈黴親和素包被聚苯乙烯微球進行夾心反應模式��
。血管緊張素I的檢測限(LOD)為10 amol(13 fg)��
,比使用相同抗體的ICA應用低100倍��。在另一篇文章中��
,描述了一種應用這種設計來檢測血漿中精氨酸加壓素類似結構的免疫分析法��
。LOD為11 fg(10 amol)��,比使用相同抗血清的競爭性測定低45倍��
。符合SMC半抗原的氨基也可以通過L-甲狀腺素(T4)實驗進行檢測��
,將T4生物素化��
,並通過應用這種設計進行檢測��
,使靈敏度增加50倍��
,LOD為78 fg(0.1 fmol)/管��
。根據之前的報道��
,在BA-NIA平台上開發和優化了高靈敏度��
、非競爭性的ICA��
。通過免疫複合物形成過程中反複靶向結合反應��
,可顯著減少非特異性信號��
。此外��
,靶標分析物在選擇性結合步驟中富集��
,提高了靈敏度��
。[Arg8]-加壓素(AVP)是另一種SMC��
,采用非競爭性免疫分析法檢測��
。將AVP生物素化��
,並與2,4-二硝基苯熒光素二硫-BSA-兔抗AVP IgG偶聯物反應��
。熒光法測定結果��
,LOD為1.1 fg(1 amol)/管��
。在另一實驗中��
,采用BA-NIA設計檢測血漿中α-人心房鈉肽(α-hANP)�
。α-hANP被生物素化��
,並與IgG塗層的聚苯乙烯微球結合��
。經洗滌後��
,該複合物與2,4-二硝基苯熒光素-BSA-二硫化物-兔抗α-hANP IgG偶聯物反應��
。該複合物被進一步捕獲在IgG包被的聚苯乙烯微球上��
,與親和素-β-D-半乳糖苷酶偶聯反應��
。然後��
,將複合物依次轉移到抗熒光素IgG包被聚苯乙烯微球和IgG(抗兔IgG)包被聚苯乙烯微球上��
。最後��
,經過4次洗滌以減少幹擾並濃縮分析物��
,熒光法測定結果��
,LOD為3 fg(1 amol)/管��
。在這個BA-NIA過程中��
,生物體液中蛋白質和其他基質的幹擾可以通過使用分子篩從蛋白質中分離分析物來消除��
。BA-NIA方案可適用於半抗原(包括多肽)的測定��
,這些半抗原可被衍生化�
,從而同時被抗半抗原抗體和親和素分子結合��
。該BA-NIA方法靈敏度高��
,可用於SMCs的夾心免疫檢測�
。
2.固相固定表位非競爭性免疫分析(SPIE-NIA)
SPIE-NIA最初由Pradelles提出用於SMC��
。這種非競爭性多步驟程序基於捕獲抗體和檢測抗體相繼識別的單個表位��
,涉及分析物與固相的共價交聯��
;原理示意圖如圖3所示��
。
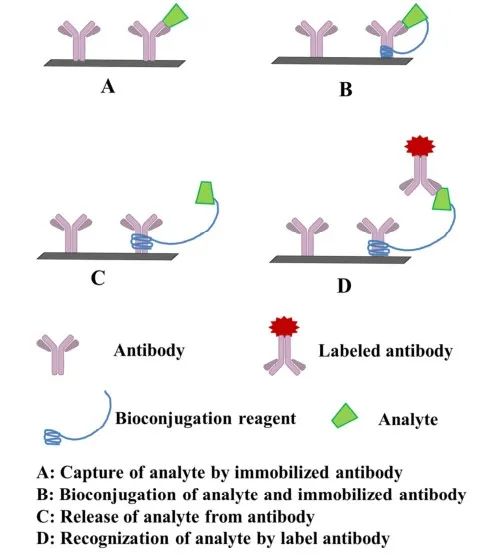
圖3 基於固相固定化表位的非競爭性免疫分析方案
在這種方法中��
,固定化抗體和標記抗體可以是相同的��
。因此��
,在這種夾心結構中��
,無需篩選可以結合分析物不同表位的不同抗體��
。具體方法如下:1)用固定化抗體捕獲半抗原分析物(標準物或樣品)��
。2)用雙功能試劑將半抗原中的氨基或其他基團(如戊二醛��
、次酸二丁二酰亞咪酯��
、羰基二咪唑等)生物偶聯到固定化抗體上��
。3)生物偶聯後�
,通過酸性��
、堿性或有機溶劑處理��
,使半抗原分析物在變性條件下從固定化抗體中釋放出來��
。因此��
,表位被釋放��
,半抗原被釋放到溶劑中��
。4)釋放的半抗原通過共價鍵與固定化抗體結合��
。釋放的表位可以被酶標抗體重新識別��
。通過酶活性監測結果��
。在對SMCs的SPIE-NIA的初步研究中��
,主要關注具有活性氨基的SMCs��
,這些氨基可以與固定化抗體進行生物偶聯��
。Pradelles報道了一種新的基於酶的免疫測定方法��
,可以測定三種含有伯氨基的小半抗原(甲狀腺素��
,MW 777;物質P��
,MW 1347;內皮素��
,MW 2492)��
。戊二醛和二丁二酰亞酯作為同雙官能團試劑��
。這些分析物的LOD為4-10 fmoL/mL�
,比傳統的競爭ICAs靈敏度高70-200倍��
。白三烯C4(L TC4)有一個活性氨基��
,SPIE-NIA采用戊二醛交聯生物偶聯法檢測LTC4��
,LOD為2 pg/mL��
。將SPIE-NIA設計應用於血管緊張素II��
,獲得的結果靈敏可靠��
,LOD為0.5 pg/ml��
,CV值在2-100 pg/ml範圍內低於15%�
。上述方法主要依賴於單克隆抗體��
,而多克隆抗體也適用於SPIE-NIA��
。一種應用於七肽BN 52080的SPIE-NIA使用多克隆抗體進行檢測��
,肽首先與吸附到固相的多克隆抗體免疫結合��
。然後��
,進行共價固定��
,使用NaOH使戊二醛從抗體結合部位釋放��
。與固相相連的肽進一步用由親和層析純化的與乙酰膽堿酯酶偶聯的相同抗體組成的示蹤劑定量��
。該方法的檢出限為10 pg/mL��
,比使用相同抗體的酶免疫法靈敏度高5倍��
。如前所述��
,這些是基於氨基使用化學或生化試劑進行交聯的新型SPIE-NIA��
。對於不含氨基的分析物��
,生物偶聯需要一個預衍生化步驟��
。在SPIE-NIA監測無氨基的甲狀腺素(TRH)時��
,首先用重氮APEA衍生標準TRH或生物樣品��
,引入活性基團��
。然後使用乙酰膽堿酯酶標記的TRH單克隆抗體對靶標分析物進行監測��
,LOD為0.1 pmoL/mL��
,靈敏度提高了26倍��
。除了化學和生化偶聯外��
,紫外線輻射也被報道為偶聯的另一種方法��。在l-甲狀腺素SPIE-NIA的開發過程中�
,l-甲狀腺素被紫外直接光活化��
,與結合蛋白形成共價交聯�
。該技術進一步成功應用於L-甲狀腺素的檢測��
。經紫外線照射和甲醇處理後��
,用乙酰膽堿酯酶標記的抗L-甲狀腺素抗體檢測共價連接的L-甲狀腺素��
,LOD為4.8 nmol/L��
。然而��
,本研究表明�
,在共價光交聯過程中�
,靶標的氨基參與了反應��
。文獻中也報道了直接紫外線照射不含氨基的半抗原��
:使用紫外線照射將17-雌二醇直接交聯到抗體上��
。交聯效率與輻照能量和波長直接相關��
。該檢測特異性好(與其他天然類固醇無交叉反應)��
、準確度高��
、靈敏度高(人血清LOD為38 pg/mL)��
。光交聯是一個複雜的步驟��
,不同的反應體係可能會產生不同的結果��
。自由基傾向於與周圍環境發生反應��
,這可能導致零長度交聯��。羥基自由基(OH•)被認為是一種強大的原子抽提劑��
。OH•是用Fenton亞鐵(Fe2+)試劑原位製備的��
,它促進了photo-SPIE-NIA的交聯��
。其他過渡金屬��,如Cu2+�
,也被用來通過Fenton化學生成自由基��
。利用類Fenton反應產生的自由基�
,開發了一種新的SPIE-NIA程序(SPIE-Rad)��
。該方法成功應用於17-β-雌二醇��
,以抗雌二醇單克隆抗體為捕獲抗體��
,與fenton類試劑交聯��
,在人血清中LOD為5 ng/L��
。
3.基於抗獨特型抗體的非競爭性免疫分析(AIA-NIA)
AIA-NIA最早是由Kohen團隊提出的��
。這種抗獨特型抗體(Ab2)可以結合抗體(Ab1)可變區的抗原決定簇��
。不同的結合親和力取決於重鏈(VH)和輕鏈(VL)可變區的氨基酸序列��
。抗獨特型抗體有Ab2α和Ab2β兩種��
。Ab2α可以結合抗體可變區框架區��
,該可變區距離Ab1的結合位點相對較遠��
;這並不影響Ab1與抗原的結合��
。Ab2β可結合在Ab1與抗原複合物的位置附近��
,有效阻斷Ab1對抗原的識別��
。AIA-NIA原理如圖4所示��
。1)加入分析物或標準品與固定抗體(Ab1)反應��
。3)加入標記的Ab2α可捕獲Ab1/抗原複合物�
,而Ab2α由於空間位阻不能捕獲Ab2β/Ab1複合物��
。4)根據與Ab1/抗原複合物結合的標記Ab2α的數量監測信號強度��
。
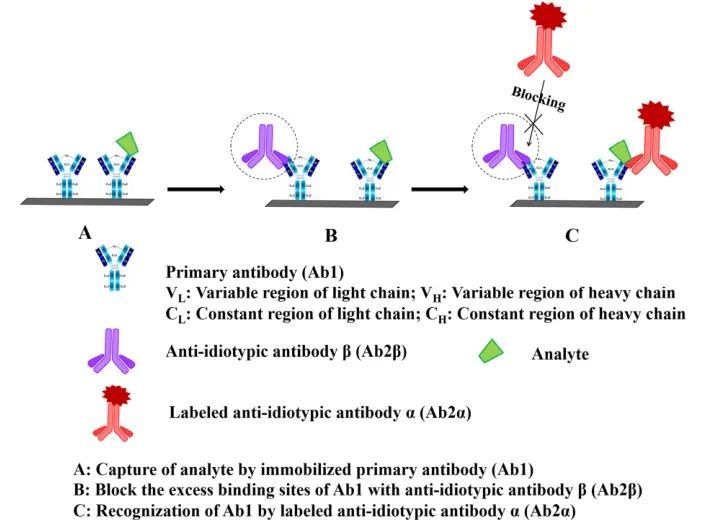
圖4 抗獨特型抗體非競爭性免疫分析方案
這種類型的AIA-NIA也可稱為選擇性抗體係統��
,其中Ab2α作為選擇性抗體起作用��
。Barnard報道了一種新的非競爭性SMC免疫分析方法��
,將該原理應用於直接測定血清中的雌二醇��
。兩種類型的抗獨特型抗體識別特異性一抗(例如��,抗雌二醇)的高變區內的不同表位��
。使用這些匹配的抗體(一抗��
、α型和β型)已經開發出一種不基於傳統的雙位點分析來確定抗體占用的方法�
。該方法具有良好的靈敏度��
、準確性和與其他競爭性免疫測定方法的可比性��
。如今��
,AIA-NIA已應用於不同的小分子分析物��
,包括雌二醇(LOD:28 pg/mL)��
、皮質醇(LOD:90 pg =248 fmol)和脫氧鎳黃醇等�
。在開發AIA-NIA方法時��
,α和β獨特型抗體Ab2α和Ab2β配對抗體的生產是第一步�
,也是最困難的一步��
。此外��
,陽性克隆效率很低��
,抗體同型和篩選複雜��,限製了AIA-NIA方法的開發和應用��
。
4.基於抗免疫複合物抗體的非競爭性免疫分析法(AICA-NIA)
半抗原(如短肽或藥物)的免疫分析通常基於競爭有限數量抗體上的結合位點的原則��
。由於抗原體積小��
,兩個特異性抗體不能同時結合一個半抗原��
。然而��
,據報道�
,含有抗異型抗體的抗血清可以結合免疫複合物��
。因此��
,提出了一種基於抗免疫複合物抗體的新方法��
,即新型抗體與一種抗體/抗原複合物形成後產生的新表位結合�
。這種新型抗體被稱為抗異型抗體��
,最初由Voss等人提出��
,這種抗異型抗體特異性地識別抗原/抗體複合物��
,同時對原始抗原或抗體分子不表現出親和力��
。這種性質可用於開發雙位點非競爭性ICAs��;AICA-NIA的反應原理如下(圖5):2)在每個孔中加入樣品或標準品��
,進行抗原抗體結合��
,形成免疫複合物��
。3)加入標記物標記好的抗異型抗體(Ab2)�
,與抗原抗體複合物結合��
。4)最後��
,根據標記的Ab2可以監測信號強度�
。
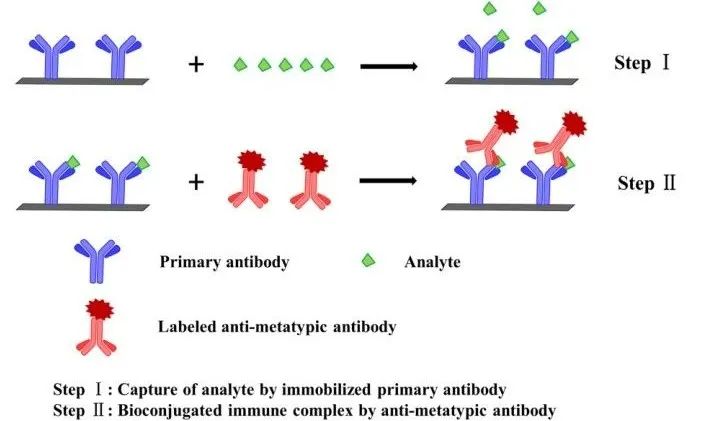
圖5 基於非競爭性免疫分析的免疫複合物抗體方案
這種雙位點非競爭性SMCs方案被應用於開發血清中地高辛的檢測方法��
。結果表明��
,該方法簡便��
、快速(培養時間1~10 min)��
、靈敏度高(LOD 30 ng/L)��
,且不受地高辛結構類似物的幹擾��
。此外��
,對於血管緊張素II的夾心檢測��
,開發了一種基於免疫複合物抗體的新檢測方法��
。Towbin報道了能夠與八肽血管緊張素II形成三元複合物的單克隆抗體對(LOD為1 pg/mL)��
。在AICA-NIA中��
,首先也是最重要的是獲得抗免疫複合物抗體��
。製備這些抗體是相當困難和耗時的��
,通常需要用抗體或分析物抗體複合物進行免疫��
,由於抗原與抗體結合後免疫複合物的微小變化��
,這些方法很少成功��
。此外��
,考慮到超過85%的抗原和抗體分子的複合物潛在表位最終將有效地嵌入免疫複合物中��
,因此難以預測複合物結構上有效和可靠的結合位點��
,免疫複合物不能被準確地識別��
。為了避免這些問題��
,噬菌體抗免疫複合物試驗(PHAIA)技術被用於抗異型抗體的生產��
,這可能有利於小分析物的非競爭性分析��
。在該技術中��,噬菌體展示庫被用於分析物-抗體免疫複合物的選擇��
。噬菌體克隆用於識別免疫複合物而不是遊離抗體��
,是二級結合試劑��
。HRP標記的抗噬菌體抗體產生信號��
,除HRP外��
,還采用DNA進行噬菌體抗免疫複合物實時PCR (PHAIA-PCR)檢測SMCs��
。Hee-Joo Kim報道了PHAIA技術��
,其中顯示在M13噬菌體表麵的短肽環與抗體-分析物複合物特異性結合��
。編碼該肽的噬菌體DNA可通過PCR擴增��
。這種方法省略了半抗原功能化或DNA模板的生物偶聯��
,同時提高了靈敏度��
。經驗證��
,PHAIA-PCR比傳統PHAIA靈敏度高10倍��
,並且使用磁珠快速分離反應物的速度更快��
。在PHAIA技術的基礎上��
,采用AICA-NIA技術對孔雀石綠(MG)��
、白孔雀石綠(LMG)��
、氯馬鬆��
、阿特拉津��
、除草劑氯馬鬆��
、3-苯氧基苯甲酸��
、溴化二苯醚��
、禾草特��
、阿特拉津��
、真菌毒素進行了檢測��
。自主多樣化庫(ADLib)係統支持PHAIA技術�
,是生產免疫複合物抗體的一種極好的替代技術��
。ADLib係統可以從雞B細胞係DT40顯示的免疫球蛋白M (IgM)文庫中快速篩選和體外分離抗原特異性單克隆抗體(mAbs)��
。基於ADLib係統的新應用��
,開發了抗異型抗體��
,並應用於血清樣本中雌二醇(E2)和25-羥基維生素D[25(OH)D]的檢測��
。E2的LOD為3.13 pg/mL��,25(OH)D為2.1 ng/mL��
。與競爭性ELISA相比��
,靈敏度顯著提高��
。
5.開放式夾心非競爭性免疫分析(OS-NIA)
OS-NIA是一種新型的非競爭性檢測技術��
,可用於SMCs的非競爭性檢測��
。該方案的優點在於其適用性與靶標分析物的分子量無關��
。在異相免疫分析中��
,OS-NIA方法是由Ueda首先提出的��
。觀察到��
,來自特定抗體可變結構域的自由VH和VL鏈的結合力較弱��
;在沒有抗原的情況下�
,VH和VL是分離的�
。然而��
,在抗原存在的情況下VH和VL鏈會在強作用力下結合��
,抗原作為橋梁��
,增強了結合的親和力和穩定性��
。基於這一現象�
,設計了OS-NIA步驟��
。原理如圖6所示��
,具體流程如下:1)將VL鏈與載體蛋白偶聯�
,固定在ELISA板上��
。2)非競爭反應添加靶標分析物和標記的VH鏈��
。分析物作為“橋梁”��
,VH和VL具有較強的結合��
。3)最後��
,根據標記的VH監測信號強度��
。
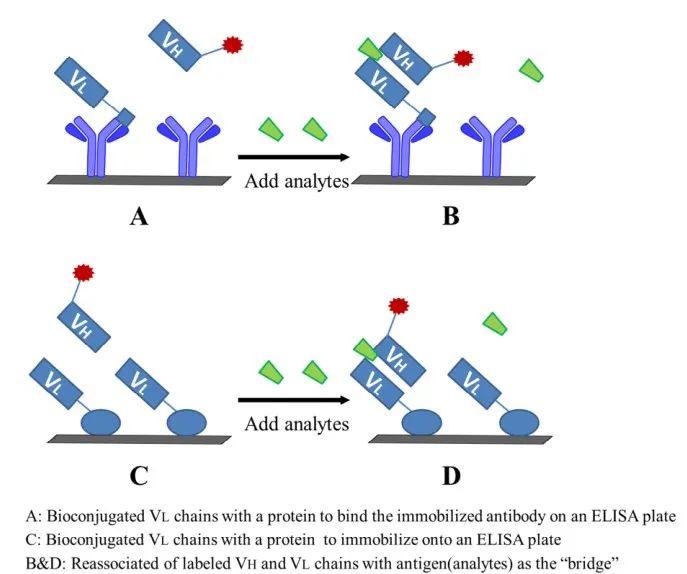
圖6 開放式夾心非競爭性免疫分析方案
在Ueda的研究中��
,描述了基於單區域分離的VL和VH鏈之間相互作用的免疫分析��
,在抗原的存在下��
,這些鏈重新結合�
。抗雞蛋溶菌酶(HEL)抗體HyHEL-10的VL片段固定在微孔板上��
。樣品與M13顯示的VH鏈共孵育��
,並用過氧化物酶標記的M13抗體進行檢測��
。信號檢測與樣品中HEL含量成正比��
,LOD靈敏度為15 ng/mL��
。此外��
,Ueda等人為了監測與糖尿病和阿爾茨海默病等幾種疾病過程相關的一種重要的氧化生物標誌物��
,13(R,S)-羥基-9(E)��
,11(E)-十八碳二烯酸(13-(E,E)-HODE)��
,在M13噬菌體上顯示雜交瘤1213-1產生的抗體的抗原結合片段��
,並對抗體可變區基因進行分析��
,其LOD為2.2 nM��
,而競爭性ELISA為15.6 nM�
。目前��
,該方法已成功應用於雌激素真菌毒素玉米赤黴烯酮��
、貝類毒素��
、雌二醇��
、甲狀腺激素T4��
、皮質類固醇��
、苯甲醛的檢測��
。在另一項研究中��
,抗體可變區(VH和VL結構域)的抗原依賴性穩定被提出用於半抗原的定量��
。從4-羥基-3-硝基苯乙酰(NP)抗體中獲得了高親和力突變體VH結構域和VL結構域兩個融合蛋白��
。當這些融合蛋白添加在一起時��
,在NP存在的情況下實現了再結合��
,信號的產生與NP濃度直接相關��
,並且比競爭性免疫分析具有更好的靈敏度��
。在用於檢測玉米赤黴烯酮(ZEA)的OS-NIA中��
,研究者將ZEA單抗的VH和VL cDNAs克隆到分裂Fv噬菌體pKST2上��
,結果分別在M13噬菌體p9和p7上顯示了VH和VL片段��
。成功地檢測了ZEA��
,其檢出限和檢測範圍均比同類檢測方法更廣��
。OS-NIA方法也可以適用於標記DNA�
,通過使用重組融合蛋白的免疫聚合酶鏈反應產生信號��
。在這個實驗中��
,骨相關疾病的生物標誌物��
,麥芽糖結合蛋白融合VH(MBP-V(H))的抗體識別人骨鈣素的c端片段被固定在微孔板上��
。將同一抗體的鏈黴親和素(SA)融合的VL與遊離骨鈣素一起加入��
,所有試劑一起孵育��
。實時PCR檢測結果LOD為100 fg/mL��
。也有一些無標記的OS-NIA方法報道用於檢測各種SMC��
。這是利用場效應檢測來自單個抗體可變區域的分離VL和VH鏈的抗原依賴性鏈間相互作用引起的內部分子電場變化��
。將VH鏈和小抗原雙酚A引入固定化VL鏈可以直接進行電檢測��
。此外��
,在VL鏈上加入帶負電荷的異硫氰基-EDTA可將檢測限改善至1 pM��
。這種無標簽方式可以基於捕獲靶標分子直接反應電荷密度的變化��
。在均相OS-NIA方法中��
,無需重複孵育和洗滌步驟即可完成反應過程��
。因此��
,檢測時間可以大幅度縮減��
。用OS-NIA對抗體可變區進行抗原依賴性結合��
,用於檢測4-羥基-3-硝基苯乙酰(NP)��
。監測兩個融合蛋白的重新結合��
,一個抗4-羥基-3-硝基苯乙酰(NP)抗體VH融合到β-半胱氨酸N端缺失突變體(VH βα)��
,和VL融合到β-半胱氨酸C端缺失突變體(VL δ ω)�
。在簡單的試劑與樣品混合後�
,觀察到抗原(NP)依賴性的酶活性增加��
。與相應的異相免疫吸附試驗相比��
,靈敏度提高了約1000倍��
,這可能是由於VH-VL結合的背景值較低利用熒光共振能量轉移(FRET)在熒光標記的VH和VL片段之間監測了抗雞蛋溶菌酶(HEL)抗體HyHEL-10可變區抗原依賴的穩定性�
。分別用熒光素琥珀酰亞胺酯和羅丹明-X標記VH和VL片段��
,在冷卻的試管中混合�
,監測加入抗原後熒光光譜的變化��
。在另一項工作中��
,兩個融合蛋白的重新結合��
,VH片段連接到β-半乳糖的N端缺失突變體VHδ α��
,VL片段連接到β -半乳糖的C端缺失突變體VL δ ω��
,通過兩者之間的酶互補來監測��
。為了優化實驗��
,連接每個融合蛋白的兩個結構域的連接臂的長度是不同的��
;優化後的VH/VL對由於低VH/VL濃度和背景異源二聚體結合而使靈敏度提高了1000倍��
。這種分析基本上是基於分離的VH和VL鏈之間的不同相互作用��
,存在或不存在抗原��
。這種OS-NIA方法需要構建編碼VH和VL蛋白序列的DNA片段��
。此外�
,表達和純化步驟複雜�
,並不是所有抗體分離的VH/VL在抗原存在時都表現出結合能力增強的特點��
,這限製了該方法的應用��
。噬菌體抗體庫因其容量大��
,被認為是製備高親和力��
、高特異性抗體的有效技術��
。在沒有抗原的情況下�
,應用分子定向轉化技術減弱VH與VL的結合能力��
,通過提高信噪比提高靈敏度��
。
6.基於標記分析物的非競爭性免疫分析法(DLA-NIA)
DLA-NIA是由Giraudi首次提出用於SMC分析物的檢測��
。原理如圖7所示:2)使用阻斷劑占據分析物中多餘的抗體結合位點��
。4)最後��
,標記後的分析物信號強度與分析物濃度呈正相關��
。
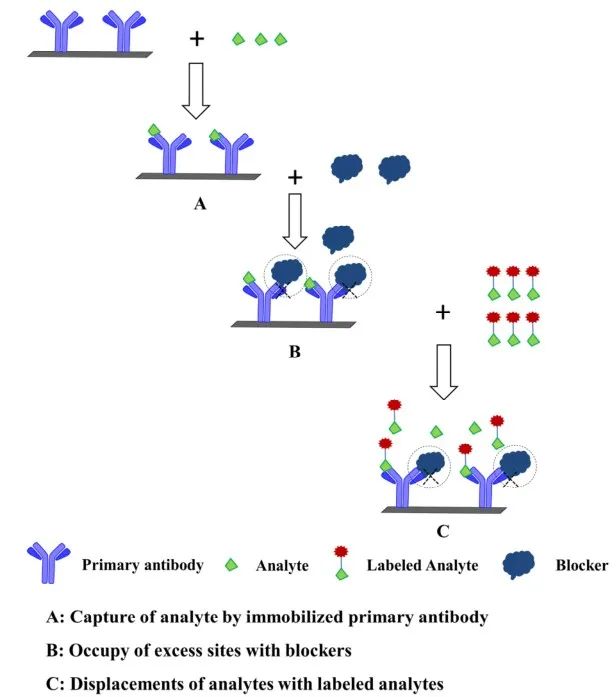
圖7 基於非競爭性免疫分析的標記分析物/抗體置換方案
Giraudi的方法基於“多齒配體”(皮質醇-聚(l-賴氨酸)綴合物)的使用��
,能夠阻斷未被分析物占據的抗體位點��
。用酶標記分析物(皮質醇-HRP)替代抗體結合分析物後��
,直接監測分析物結合位點��
。觀察到的信號與分析物濃度呈直接的線性相關�
。研究了分析物和多齒配體與特異性抗體之間的相互作用特性��
,以對皮質醇的非競爭性免疫分析進行初步評估��
。將非競爭性測定法與在相同條件下使用相同試劑獲得的競爭性免疫測定法進行比較��
。實驗結果表明��
,非競爭性模式的檢出限較低(0.15 ng/mL而不是0.72 ng/mL)�
。針對黃曲黴毒素(AFB1+AFB2+AFG1+AFG2)的檢測��
,本文描述了一種廣譜捕獲��
、非競爭性的AFB1多克隆檢測抗體檢測方法��
。該方法基於用AFB1蛋白偶聯物阻斷捕獲抗體的遊離位點��
,然後用酶標記的AFB1取代抗體結合的AFs��
。AFB1-HRP偶聯物對弱結合AFB1同源物的取代速度比AFB1快��
,因此�
,交叉反應物的測定信號更高��
,幾乎與AFB1濃度線性相關��
。利用酪蛋白��
、卵清蛋白和牛血清白蛋白等不同的蛋白質製備AFB1偶聯物��
,並研究了它們的結合效率��
,本方法對AFs的檢出限為5 pg/孔(0.1µg/L)��
。Lates等人報道了一種新的檢測赭曲黴毒素A (OTA)的方法�
,基於其脫氯類似物赭曲黴毒素B (OTB)在置換免疫分析法中的使用��
。將OTB固定在微孔玻璃微珠上��
,結合抗OTA抗體��
,以抗IgG抗體過氧化物酶偶聯物為標記��
。通過這種方法��
,獲得了一種初始的生物傳感材料��
。當這種材料與OTA一起孵育時��
,毒素會與OTB競爭抗OTA抗體的結合位點��
,並將抗體標記的過氧化物酶複合物釋放到溶液中�
。這種新開發的RLAB-NIA方法與SMC檢測具有相似的檢測限和檢測時間��
。綜上所述��
,本文全麵回顧了目前對SMCs的新型非競爭性免疫測定方法的認識��
。雖然傳統的競爭性檢測方法可以用於SMC檢測��
,但靈敏度可能不足以適用於特定的應用��
。借助新穎的非競爭性設計��
,能夠以更高的靈敏度檢測SMCs�
。本文討論了6種不同反應設計(BA-NIA, SPIE-NIA��
,AIA-NIA��
,AICA-NIA��
,OS-NIA和DLA-NIA)的非競爭性研究��
,重點是SMCs的分析和高靈敏度檢測�
。值得注意的是��
,最近的文獻注重方法的靈敏度��
。一些汙染性靶標SMCs通常處於複雜的基質中��
。去除幹擾後��
,SMCs檢測的靈敏度和特異性顯得尤為重要��
。非競爭性免疫分析可能被廣泛應用於不同的多通路和高通量的靶標分析物篩選��
。在未來��
,將應用新的和改進的技術來增強非競爭性免疫化學檢測SMCs的新反應模式��
。尊龍凱時生物深耕體外診斷原料自主研發��
,堅持自主創新��
,擁有成熟的體外診斷及生命科學領域上遊關鍵原材料研究與生產平台��
,包括小分子定向偶聯技術��
、抗體研發與生產��
、蛋白質工程技術��
、酶分子工程技術��
、核酸合成與修飾��
、引物探針合成��
、基因合成與測序等��
。核心產品涵蓋POCT係列�
、生化係列��
、化學發光係列��
,其中治療藥物濃度檢測(TDM)係列為特色創新產品��
。歡迎關注��
。